Überwachung des zerebralen Blutflusses
![]()
PSI für die Überwachung des zerebralen Blutflusses
Die einmalige Kombination aus hoher räumlicher Auflösung, einem großen Sichtfeld und einer hohen Bildrate macht das PeriCam PSI zum idealen Instrument für eine hochwertige Hirn-Bildgebung und hervorragende Überwachung von schnell eintretenden Veränderungen.
Veränderungen im zerebralen Blutfluss (CBF) sind ein charakteristisches Merkmal vieler neurologischer Erkrankungen, weshalb auch viele Studien im Bereich der Neurowissenschaft dieses Thema in den Mittelpunkt stellen. Zur Durchführung dieser Studien benötigt man Instrumente, mit denen sich diese Veränderungen überwachen lassen, vorzugsweise auf nicht-invasive Weise und in Echtzeit. Das PeriCam PSI System ist ein Blutperfusions-Bildgeber, der die Technologie der Laser-Speckle-Kontrastanalyse (LASCA) einsetzt. LASCA eröffnet neue, bislang unmögliche Wege zur Untersuchung der Mikrozirkulation. Diese Analysemethode ermöglicht die Darstellung der Gewebeblutperfusion in Echtzeit und kombiniert eine dynamische Reaktion mit räumlicher Auflösung. Die Perfusion wird dabei nicht beeinträchtigt, da weder direkter Kontakt zum Gewebe noch Kontrastmittel oder Tracer-Elemente erforderlich sind. Zur weiteren Steigerung der Nutzbarkeit wurde mit PIMSoft eine spezifische Anwendungssoftware entwickelt. In mehreren Mausmodellen wurde das PSI bereits umfassend zur Überwachung von CBF und den Veränderungen von CBF eingesetzt, um die Krankheitspathologie zu beschreiben und die Wirksamkeit der Behandlung zu überwachen.
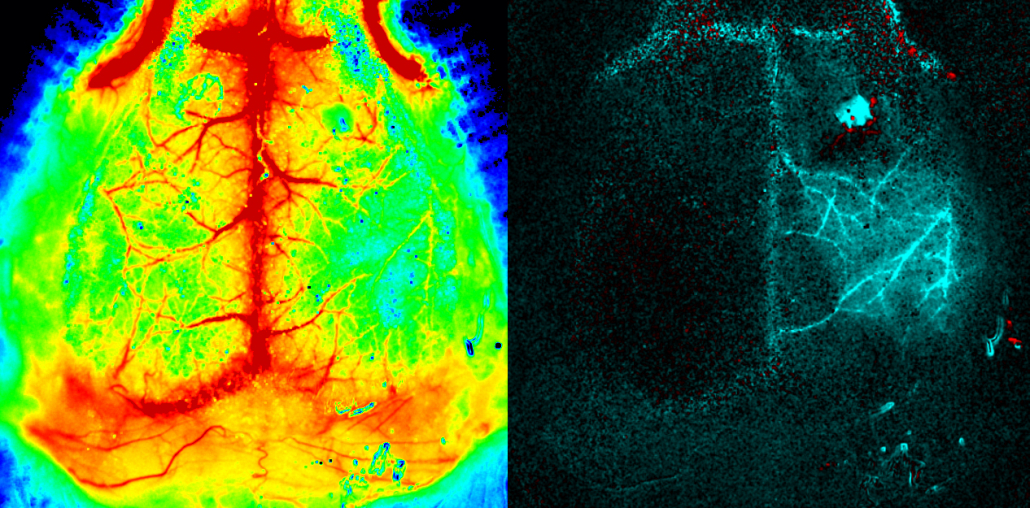
Mäusehirn. PeriCam PSI HR (Hohe Auflösung). Mit freundlicher Genehmigung von Dr. Offenhauser, Charité, Berlin, Deutschland.
Übersicht
Das PeriCam PSI hat sich in verschiedenen Bereichen auf dem Forschungsgebiet des zerebralen Blutflusses als nützliches Werkzeug
erwiesen. Ein Hauptbereich ist die Erforschung ischämischer Hirnschäden. Wird ein ischämischer oder ein hämorrhagischer Schlaganfall eingeleitet, lässt sich dessen Ausmaß mit dem PeriCam PSI bestimmen und der dynamische Prozess nach dem Schlaganfall im Zeitverlauf nachverfolgen. Ebenso können Modelle für chronische zerebrale Hypoperfusion und traumatische Hirnverletzungen mit dem PeriCam PSI analysiert werden.
Ein weiteres Feld ist die Erforschung von hämodynamischen Veränderungen des Hirns. Hierbei ist das PeriCam PSI aufgrund der hohen räumlichen Auflösung, des großen Sichtfelds und der hohen Bildrate ein ideales Instrument zur Untersuchung von schnellen Veränderung des CBF. Die Technik eignet sich auch sehr gut zur Darstellung der Wellen an Perfusionsveränderungen, die bei der Verbreitung kortikaler Entladung auftreten. Der Modus zur Differenzdarstellung wurde für genau diese Anwendung entwickelt. Kürzlich hat sich zudem gezeigt, dass die neurovaskuläre Kopplung ebenfalls eine geeignete Anwendung für diese Technik ist.
PSI zur Charakterisierung von ischämischen Hirnschäden
Dank seiner einzigartigen Merkmale eignet sich das PSI hervorragend zur Untersuchung ischämischer Hirnschäden in verschiedenen Modellen, z. B. für Schlaganfall, chronische zerebrale Hypoperfusion und traumatische Hirnverletzungen.
Großes Sichtfeld: Darstellung des gesamten Hirns ermöglicht die Bestätigung und Charakterisierung des ischämischen Schadens
Hohe räumliche Auflösung: Für die präzise Lokalisierung der Verletzung. Die Einrichtung von Regionen von Interesse (ROI) erlaubt die Messung des Verletzungsbereichs und auch die Nachverfolgung der Genesung.
Funktion „Aufzeichnung fortsetzen“: Erleichtert die Datengewinnung und Analyse bei Längsschnittuntersuchungen, da wiederholte Messungen bei demselben Patienten in einer Datei gespeichert werden. So wird es möglich, dieselben ROI im Zeitverlauf einfach zu vergleichen.
Schlaganfall
o Modell für den Verschluss der mittleren Zerebralarterie (MCAO) – In die Arterie wird ein Faden eingeführt, um den Blutfluss für einen festgelegten Zeitraum zu unterbrechen (üblicherweise für 30-120 Minuten) und einen ischämischen Schlaganfall auszulösen. Dann wird der Faden wieder entfernt, um die Perfusion wieder herzustellen 1-9.
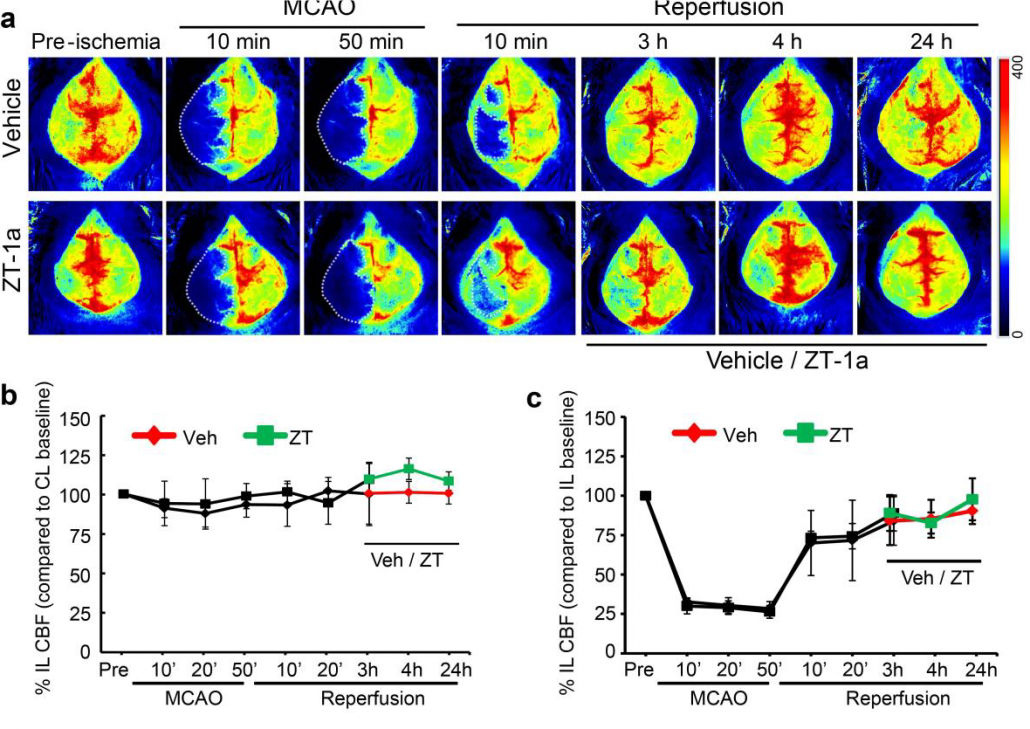
Perfusionsabbildungen eines Mäusehirns vor, während und nach einem MCAO-Verfahren sowie quantifizierte Veränderungen der Blutperfusion sowohl auf der ipsilateralen als auch der kontralateralen Seite von behandelten und unbehandelten Tieren.
Mit freundlicher Genehmigung von Dandan Sun und Iqbal H. Bhuiyan, Abteilung für Neurologie und Pittsburgh Institute for Neurodegenerative Diseases, Universität Pittsburgh. Verwendung der Abbildung mit Genehmigung von Nature Communications, ursprünglich veröffentlicht in: Zhang, J., Bhuiyan, M.I.H., Zhang, T. et al. Modulation of brain cation-Cl− cotransport via the SPAK kinase inhibitor ZT-1a. Nat Commun 11, 78 (2020). doi: 10.1038/s41467-019-13851-6
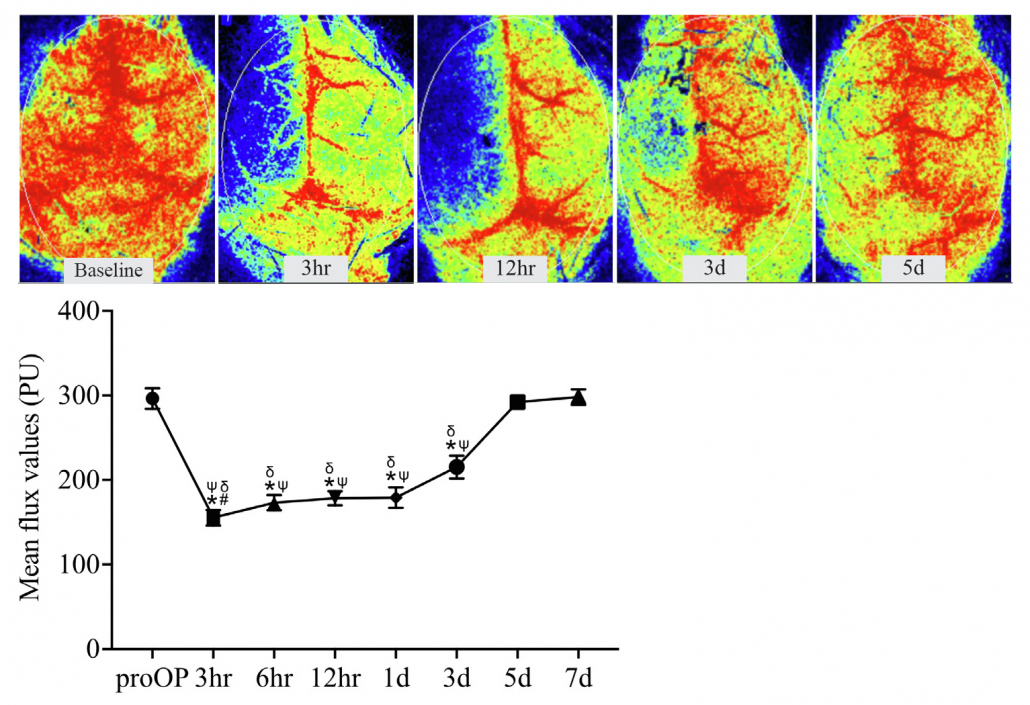
o Modell für Subarachnoidalblutungen (SAH) – Es wird ein Faden eingeführt, um die vordere Zerebralarterie zu perforieren, was einen Schlaganfall auslöst 10-13.
 Brain Research 1727 (2020) 146566
Brain Research 1727 (2020) 146566
Perfusionsabbildungen eines Mäusehirns vor und nach dem SAH-Verfahren. Dasselbe Tier wurde eine Woche nach der Verletzung beobachtet, um die Genesung auszuwerten. Bilder erstellt mit PSI HR.
Chronische zerebrale Hypoperfusion
o Modell für eine bilaterale Okklusion der Karotis (BCCAO) – Die Karotisarterien werden mit Nähten oder Mikrospulen eng und doppelt abgebunden, um in beiden Hemisphären ischämische Regionen zu schaffen 14-20.
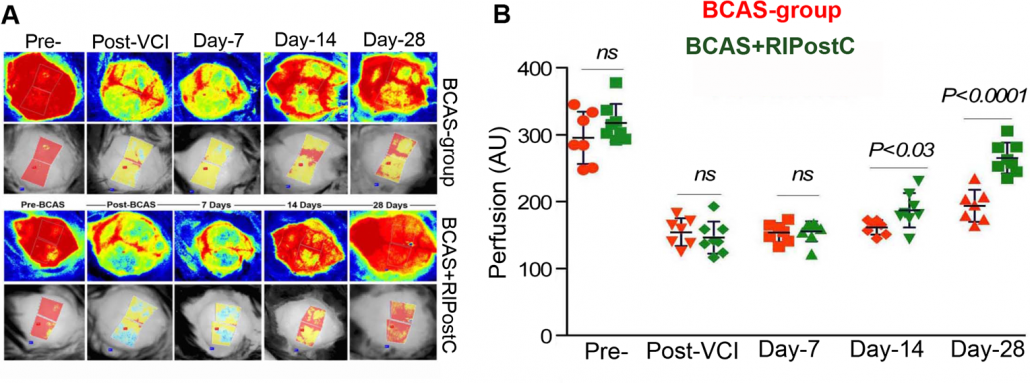
Perfusionsabbildungen eines Mäusehirns vor und nach einem BCCAO-Verfahren sowie quantifizierte Veränderungen der Blutperfusion sowohl bei behandelten als auch unbehandelten Tieren. Die Tiere wurden nach der Verletzung einen Monat beobachtet.
Mit freundlicher Genehmigung von Dr. Nasrul Hoda Georgia Regents University, Universität Georgia, und Charlie Norwood VA Medical Center, Augusta, Georgia, USA.
Verwendung der Abbildung mit Genehmigung von Translational Stroke Research. Ursprünglich veröffentlicht in: Khan, M.B., Hoda, M.N., Vaibhav, K. et al. Remote Ischemic Postconditioning: Harnessing Endogenous Protection in a Murine Model of Vascular Cognitive Impairment. Transl. Stroke Res. 6, 69–77 (2015). https://doi.org/10.1007/s12975-014-0374-6.
Traumatische Hirnverletzungen
o Modell für kontrollierten kortikalen Schlag (CCI) – Mit einer Prellvorrichtung wird eine kontrollierte Verletzung des sensomotorischen Kortex erzeugt 21-23.
o Modell für Gewichtsabwurf/Schlagbeschleunigung – Auf den ungeschützten Schädel wird ein Gewicht fallen gelassen, um eine Hirnverletzung zu erzeugen.
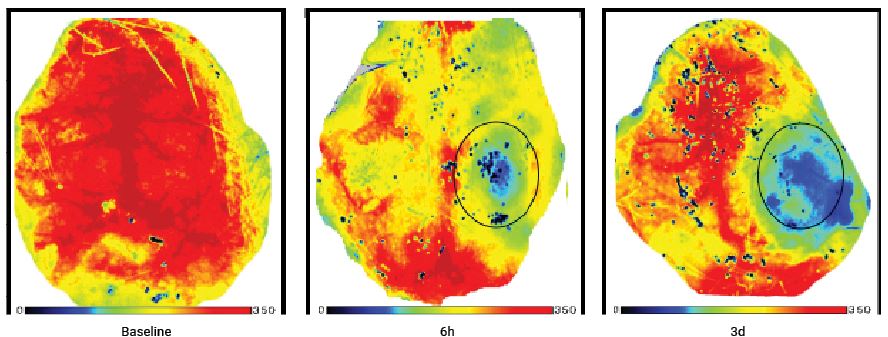
Perfusionsabbildungen eines Mäusehirns vor und nach einer traumatischen Hirnverletzung. Dasselbe Tier wurde drei Tage lang nach der Verletzung beobachtet.
Mit freundlicher Genehmigung von Dr. Han Liu Abteilung für Neurochirurgie, First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, VR China
H. Liu et al./Brain Research 1700 (2018) 118–125
PSI zur Charakterisierung zerebraler hämodynamischer Veränderungen
Dank seiner einmaligen Merkmale kann das PSI Perfusionsänderungen räumlich und zeitlich darstellen, weshalb es dazu geeignet ist, kleine dynamische Veränderungen des CBF als Reaktion auf Stimulierungen zu untersuchen. Abnormale Reaktionen sind frühe Anzeichen für eine kognitive Dysfunktion.
Mit der hohen Bildrate und räumlichen Auflösung lassen sich dynamische Veränderungen erfassen, die in den zerebralen Mikrogefäßen kleiner Strukturen durch externe Stimulierungen ausgelöst wurden.
Differenzbilder ermöglichen eine bessere Darstellung von subtileren Veränderungen des CBF.
Neurovaskuläre Kopplung (NVC)
Ein kritischer homöostatischer Mechanismus, der sicherstellt, dass der CBF auf angemessene Weise an den gestiegenen Sauerstoff- und Nährstoffbedarf von aktivierten Neuronen angepasst wird, woraus sich eine funktionelle Hyperämie ergibt. NVC spielt eine wesentliche Rolle für den Erhalt von gesunden kognitiven Funktionen. Das PSI wird verwendet, um hämodynamische Veränderungen im somatosensorischen Kortex aufzuzeichnen, die sich aus einer elektrischen Stimulierung des Hüftnervs 24 oder einer Schnurrhaarstimulierung ergeben 25-28. Eine gestörte NVC trägt zur altersbedingten Verschlechterung der kognitiven Leistungsfähigkeit bei.
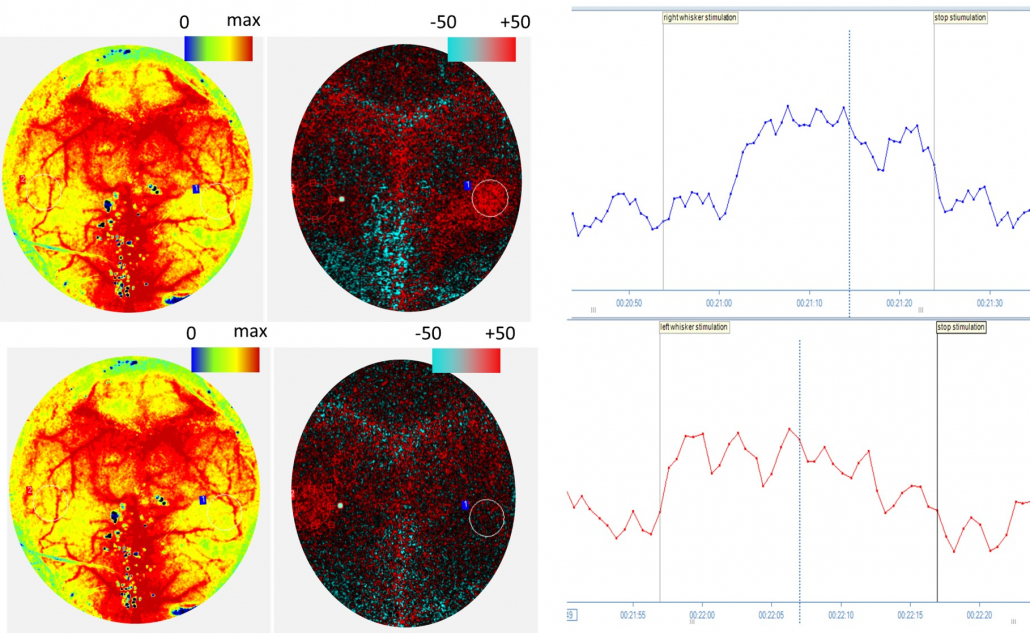
Perfusionsbilder des Mäusehirns, sowohl als absolute als auch Differenzbilder, von einer 30-sekündigen Schnurrhaarstimulierung der rechten (oben) und linken (unten) Schnurrhaare. Grafische PIMSoft-Daten der ROI des Barrel-Kortex während Stimulierungen, bei denen ein Perfusionsanstieg zu erwarten ist. Kognitive Dysfunktion führt zu einer Reduktion des Perfusionsanstiegs nach Stimulierung.
Mit freundlicher Genehmigung von Dr. Stefano Tarantini und Dr. Zoltan Ungvari vom University of Oklahoma Health Science Center, Oklahoma City, USA.
Kortikale Streudepolarisierung (CSD)
Wellen eines abrupten, fast vollständigen Zusammenbruchs von neuronalen transmembranen Ionengradienten, die zytotoxische Ödeme hervorrufen, sich mit ca. 3 mm/Min. durch die graue Hirnmasse bewegen und zur Ausbreitung einer Ischämie führen. CSD ist die Hauptursache für neurodegenerative Erkrankungen nach einer akuten Hirnverletzung. Das PSI wird verwendet, um hämodynamische Veränderungen nach einem Nadelstich oder der Anwendung hochkonzentrierter Kaliumlauge aufzuzeichnen 29-32.
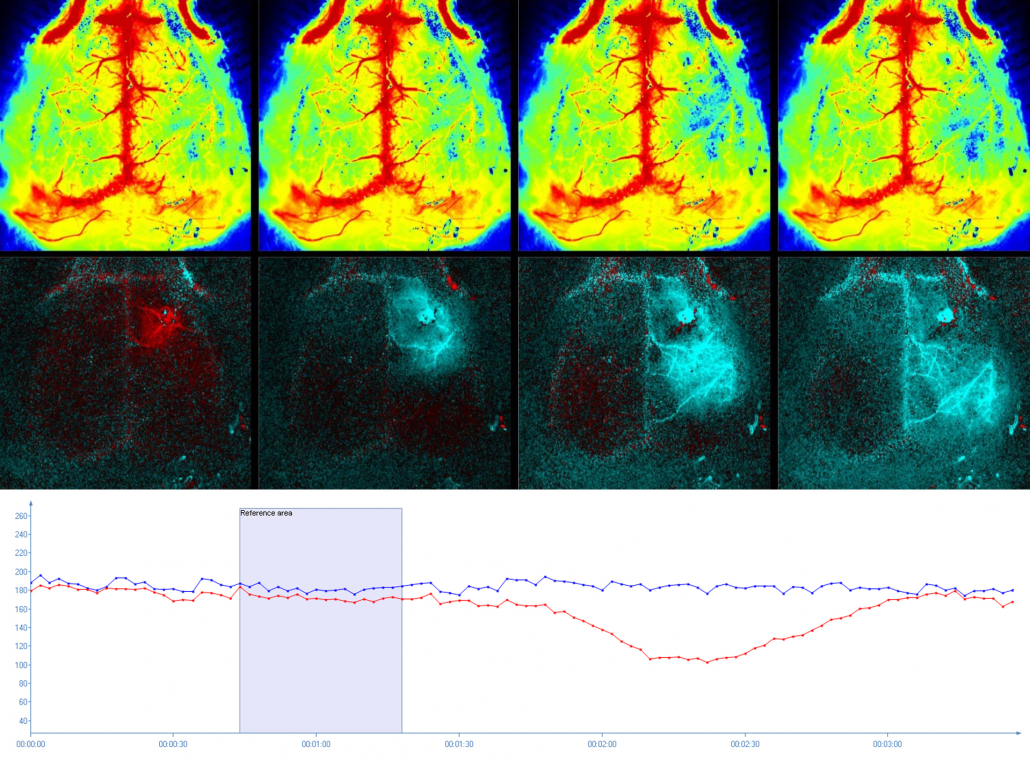
Streudepolarisierung im Mäusehirn, dargestellt mit dem PeriCam PSI HR. Die absolute Perfusion (obere Reihe) lässt sich visualisieren und quantifizieren (Diagramm) und anhand des speziell entwickelten Differenzbildmodus (untere Reihe) lässt sich die von der SD-Welle ausgelöste Perfusionsveränderung auf spektakuläre Weise nachverfolgen. Mit freundlicher Genehmigung der Charité, Berlin, Deutschland.
Referenzen:
1. Morroniside promotes angiogenesis and further improves microvascular circulation after focal cerebral ischemia/reperfusion. T. Liu, B. Xiang, D. Guo, F. Sun, Re. Wei, G. Zhang, H. Aia, X.Tian, Z. Zhu, W. Zheng, Y. Wanga W.Wang. 2016, Brain Res Bull. , pp. 111-118.
2. C‐C Chemokine Receptor Type 5 (CCR5)‐Mediated Docking of Transferred Tregs Protects Against Early Blood‐Brain Barrier Disruption After Stroke. Peiying Li, Long Wang, Yuxi Zhou, Yu Gan, Wen Zhu, Yuguo Xia, Xiaoyan Jiang, Simon Watkins, Alberto Vazquez, Angus W. Thomson, Jun Chen, Weifeng Yu, Xiaoming Hu. 2017, Journal of the American Heart Association, p. e006387.
3. Endothelium-targeted overexpression of heat shock protein 27 ameliorates blood–brain barrier disruption after ischemic brain injury. Yejie Shi, Xiaoyan Jiang, Lili Zhang, Hongjian Pu, Xiaoming Hu, Wenting Zhang, Wei Cai, Yanqin Gao, Rehana K. Leak, Richard F. Keep, Michael V. L. Bennett, and Jun Chen. 2017, PNAS, Proceedings of the National Academy of Sciences, pp. E1243-E1252.
4. Brain ischemic preconditioning protects against ischemic injury and preserves the blood-brain barrier via oxidative signaling and Nrf2 activation. Tuo Yang, Yang Sun, Leilei Mao, Meijuan Zhang, Qianqian Li, Lili Zhang, Yejie Shi, Rehana K. Leak, Jun Chen, Feng Zhang. 2017, Redox Biology, pp. 323-337.
5. Brain-Derived Glia Maturation Factor β Participates in Lung Injury Induced by Acute Cerebral Ischemia by Increasing ROS in Endothelial Cells. Fei-Fei Xu, Zi-Bin Zhang, Yang-Yang Wang & Ting-Hua Wang. 2018, Neuroscience Bulletin, pp. 1077-1090.
6. The microRNA miR-7a-5p Ameliorates Ischemic Brain Damage by Repressing α-Synuclein. Kim T, Mehta SL, Morris-Blanco KC, Chokkalla AK, Chelluboina B, Lopez M, Sullivan R, Kim HT, Cook TD, Kim JY, Kim H, Kim C, Vemuganti R. 2018, Science Signaling, p. eaat4285.
7. Assessing the effects of Ang-(1-7) therapy following transient middle cerebral artery occlusion. M. M. C. Arroja, E. Reid, L. A. Roy, A. V. Vallatos, W. M. Holmes, S. A. Nicklin, L. M. Work & C. McCabe. 2019, Scientific Reports, p. 3154.
8. Modulation of brain cation-Cl− cotransport via the SPAK kinase inhibitor ZT-1a. Jinwei Zhang, Mohammad Iqbal H. Bhuiyan, Ting Zhang, Jason K. Karimy, Zhijuan Wu, Victoria M. Fiesler, Jingfang Zhang, Huachen Huang, Md Nabiul Hasan, Anna E. Skrzypiec, Mariusz Mucha, Daniel Duran, Wei Huang, Robert Pawlak, Lesley M. Foley, T. Kevin Hitc. 2020, Nature Communications.
9. Endothelium-targeted deletion of the miR-15a/16-1 cluster ameliorates blood-brain barrier dysfunction in ischemic stroke. Feifei Ma, Ping Sun, Xuejing Zhang, Milton H. Hamblin, and Ke-Jie Yin. 2020, Science Signaling.
10. Early Changes of Brain Perfusion After Subarachnoid Hemorrhage – the Effect of Sodium Nitroprusside. M Kolar, K Nohejlova, J Mares, J Pachl. 2016, Physiological Research, pp. S591-S599.
11. Changes of Cortical Perfusion in the Early Phase of Subarachnoid Bleeding in a Rat Model and the Role of Intracranial Hypertension. M Kolar, K Nohejlova, F Duska, J Mares, J Pachl. 2017, Physiological Research, pp. S545-S551.
12. Neuroprotective Effects of Nasopharyngeal Perfluorochemical Cooling in a Rat Model of Subarachnoid Hemorrhage. Mustafa Yavuz Samanci, Gennaro Calendo, Sandy T. Baker, Kadir Erkmen, Michael W. Weaver, Marla R. Wolfson. 2019, World Neurosurgery, pp. e481-e492.
13. Tauroursodeoxycholic acid prevents ER stress-induced apoptosis and improves cerebral and vascular function in mice subjected to subarachnoid hemorrhage. Xin Chen, Jianhao Wang, Xiangliang Gao, Ye Wu, Gang Gu, Mingming Shi, Yan Chai, Shuyuan Yue, Jianning Zhang. 2020, Brain Research, p. 146566.
14. TREM-2-p38 MAPK signaling regulates neuroinflammation during chronic cerebral hypoperfusion combined with diabetes mellitus. Jiawei Zhang, Yu Liu, Yaling Zheng, Yan Luo, Yu Du, Yao Zhao, Jian Guan, Xiaojie Zhang & Jianliang Fu. 2020, Journal of Neuroinflammation, Vol. 17.
15. Chronic Remote Ischemic Conditioning Is Cerebroprotective and Induces Vascular Remodeling in a VCID Model. Mohammad Badruzzaman Khan, Sherif Hafez, Md. Nasrul Hoda, Babak Baban, Jesse Wagner, Mohamed E. Awad, Hasith Sangabathula, Stephen Haigh, Mohammed Elsalanty, Jennifer L. Waller, David C. Hess. 1, 2018, Translational Stroke Research, Vol. 9, pp. 51-63.
16. Astroglial NF-kB contributes to white matter damage and cognitive impairment in a mouse model of vascular dementia. Raman Saggu, Toni Schumacher, Florian Gerich, Cordula Rakers, Khalid Tai, Andrea Delekate and Gabor C. Petzold. 4, 2016, Acta Neuropathologica Communications, Vol. 76.
17. Astrocyte-derived lipocalin-2 mediates hippocampal damage and cognitive deficits in experimental models of vascular dementia. Suk, Jae‐Hong Kim Pan‐Woo Ko Ho‐Won Lee Ji‐Young Jeong Maan‐Gee Lee Jong‐Heon Kim Won‐Ha Lee Ri Yu Won‐Jong Oh Kyoungho. 2017, Glia, pp. 1-20.
18. Cerebral microvascular dysfunction in metabolic syndrome is exacerbated by ischemia–reperfusion injury. Nathalie Obadia, Marcos Adriano Lessa, Anissa Daliry, Raquel Rangel Silvares, Fabiana Gomes, Eduardo Tibiriçá & Vanessa Estato. 67, 2017, BMC Neuroscience, Vol. 18.
19. The impact of early aerobic exercise on brain microvascular alterations induced by cerebral hypoperfusion. Marina Leardini-Tristão, Juliana Pereira Borges, Felipe Freitas, Raquel Rangel, Anissa Daliry,. 2017, Brain Research, Vol. 1657, pp. 43-51.
20. The Role of Autophagy in the Correlation Between Neuron Damage and Cognitive Impairment in Rat Chronic Cerebral Hypoperfusion. Wenying Zou, Yufei Song, Yumei Li, Yu Du, Xiaojie Zhang, Jianliang Fu. 1, 2018, Molecular Neurobiology, Vol. 55, pp. 776-791.
21. Clinical and Basic Evaluation of the Prognostic Value of Uric Acid in Traumatic Brain Injury. Liu H, He J, Zhong J, Zhang H, Zhang Z, Liu L, Huang Z, Wu Y, Jiang L, Guo Z, Xu R, Chai W, Huo G, Sun X, Cheng C. 10, 2018, International Journal of Medical Sciences, Vol. 15, pp. 1072-1082.
22. Selective activation of cannabinoid receptor-2 reduces neuroinflammation after traumatic brain injury via alternative macrophage polarization. Molly Braun, Zenab T.Khan, Mohammad B.Khan, Manish Kumar, Ayobami Ward, Bhagelu R.Achyut, Ali S.Arbab, David C.Hess, Md. Nasrul Hoda, Babak Baban, Krishnan M.Dhandapani, Kumar Vaibhav. 2018, Brain, Behavior, and Immunity, Vol. 68, pp. 224-237.
23. Evolution of cerebral perfusion in the peri-contusional cortex in mice revealed by in vivo laser speckle imaging after traumatic brain injury. Han Liu, Junchi He, Zhaosi Zhang, Liu Liu, Gang Huo, Xiaochuan Sun, Chongjie Cheng. 2018, Brain Research, Vol. 1700, pp. 118-125.
24. Regulation of cortical blood flow responses by the nucleus basalis of Meynert during nociceptive processing. Thierry Paquette, Ryota Tokunaga, Sara Touj, Hugues Leblond, Mathieu Piché. 149, 2019, Neuroscience Research, pp. 22-28.
25. Demonstration of impaired neurovascular coupling responses in TG2576 mouse model of Alzheimer’s disease using functional laser speckle contrast imaging. Stefano Tarantini, Gabor A. Fulop, Tamas Kiss, Eszter Farkas, Dániel Zölei-Szénási, Veronica Galvan, Peter Toth, Anna Csiszar, Zoltan Ungvari, Andriy Yabluchanskiy. 4, 2017, GeroScience, Vol. 39, pp. 465-473.
26. Overexpression of catalase targeted to mitochondria improves neurovascular coupling responses in aged mice. Anna Csiszar, Andriy Yabluchanskiy, Anna Ungvari, Zoltan Ungvari & Stefano Tarantini. 5, 2019, GeroScience, Vol. 41, pp. 609-617.
27. Pharmacological or genetic depletion of senescent astrocytes prevents whole brain irradiation–induced impairment of neurovascular coupling responses protecting cognitive function in mice. Andriy Yabluchanskiy, Stefano Tarantini, Priya Balasubramanian, Tamas Kiss, Tamas Csipo, Gábor A. Fülöp, Agnes Lipecz, Chetan Ahire, Jordan DelFavero, Adam Nyul-Toth, William E. Sonntag, Michal L. Schwartzman, Judith Campisi, Anna Csiszar & Zoltan Ungvari. 2020, GeroScience.
28. Treatment with the mitochondrial-targeted antioxidant peptide SS-31 rescues neurovascular coupling responses and cerebrovascular endothelial function and improves cognition in aged mice. Stefano Tarantini, Noa M. Valcarcel-Ares, Andriy Yabluchanskiy, Gabor A. Fulop, Peter Hertelendy, Tripti Gautam, Eszter Farkas, Aleksandra Perz, Peter S. Rabinovitch, William E. Sonntag, Anna Csiszar, Zoltan Ungvari. 2, 2018, Aging Cell, Vol. 17, p. e12731.
29. The antagonism of prostaglandin FP receptors inhibits the evolution of spreading depolarization in an experimental model of global forebrain ischemia. Dániel P. Varga, Írisz Szabó, Viktória É. Varga, Ákos Menhyárt, Orsolya M. Tóth, Mihály Kozma, Armand R. Bálint, István A. Krizbai, Ferenc Bari, Eszter Farkas. 2020, Neurobiology of Disease, Vol. 137, p. 104780.
30. Na+/K+-ATPase α isoform deficiency results in distinct spreading depolarization phenotypes. Clemens Reiffurth, Mesbah Alam, Mahdi Zahedi-Khorasani, Sebastian Major and Jens P Dreier. 3, 2019, Journal of Cerebral Blood Flow & Metabolism, Vol. 40, pp. 622-638.
31. Systemic administration of l-kynurenine sulfate induces cerebral hypoperfusion transients in adult C57Bl/6 mice. Dániel Péter Varga, Ákos Menyhárt, Tamás Puskás, Ferenc Bari, Eszter Farkas, Zsolt Kis, László Vécsei, József Toldi, Levente Gellért. 2017, Microvascular Research, Vol. 114, pp. 19-25.
32. Ansari MZ, Kang EJ, Manole MD, Dreier JP, Humeau-Heurtier A. Monitoring microvascular perfusion variations with laser speckle contrast imaging using a view-based temporal template method. s.l. : Microvascular Research, 2017. pp. 49-59. Vol. 111.
Füllen Sie das Formular aus, um mehr Informationen zu erhalten
Haftungsausschluss: Es ist möglich, dass die Produkte auf der Perimed-Website nicht in allen Märkten zum Verkauf freigegeben sind.